"Amo como ama o amor.Não conheço nenhuma outra razão para amar senão amar.Que queres que te diga,além de que te amo,se o que quero dizer -te é que te amo."
Fernando Pessoa
Fernando Pessoa
sábado, 30 de abril de 2011
Acidos e Bases 2 anos
Àcido-base e ph
No nosso quotidiano, muitas vezes nos questionamos onde podemos encontrar ácidos e bases (fig.1). Um dos conceitos que mais tem evoluído com o desenvolvimento da Química é o de ácido-base.
Para os egípcios, gregos e romanos o vinagre era a única substância ácida conhecida. Ele resultava da “azedia” ou oxidação do vinho pelo ar. Ácido significava, literalmente, azedo.
Entre os alcalis (da palavra árabe al kali, que significava cinzas de plantas), nome que se dá ás bases que se dissolvem em água, figuravam a “potassa” (carbonato de potássio), obtida de cinzas de madeira, a “soda” (carbonato de sódio), obtida da evaporação de águas minerais, e a “cal” (óxido de cálcio), obtida pelo aquecimento de conchas.
As bases são as substâncias capazes de produzir as soluções básicas ou alcalinas, sendo frequentemente escorregadias; o bicarbonato de sódio e o sabão são bases, assim como a soda cáustica, uma substância que pode queimar a pele.
Segundo Lewis, uma base é qualquer substância doadora de um par de electrões.
As bases mais importantes no laboratório são : hidróxido de sódio : NaHO, hidróxido de cálcio : Ca(HO)2 , hidróxido de magnésio : Mg(HO)2, hidróxido de amónio : NH4HO.
Na natureza os ácidos encontram-se nos frutos: o ácido cítrico é responsável pelo sabor amargo dos limões; o vinagre contém ácido acético; o ácido tânico da casca das árvores é usado no curtimento de peles. Os ácidos minerais mais fortes têm sido preparados desde a Idade Média. Um destes ácidos, aqua fortis (ácido nítrico), era usado pelos analistas para separar o ouro da prata. As baterias dos automóveis contêm ácido sulfúrico, um ácido forte e corrosivo. Uma base apresenta características opostas às de um ácido.
Os ácidos são as substâncias capazes de produzir as soluções ácidas. Os ácidos mais importantes no laboratório são : ácido clorídrico: HCl, ácido sulfuríco : H2SO4, , ácido nítrico : HNO3, ácido fosfórico : H3PO4, ácido acético : CH3COOH.
Segundo Lewis, um ácido é qualquer substância aceitadora de um par de electrões.
Há ainda substâncias que dissolvidas em água não tem comportamento ácido nem básico. São as soluções neutras. São exemplos, o cloreto de sódio e o sulfato de sódio em soluções aquosas
No entanto, as soluções ácidas não são todas iguais, assim como as soluções alcalinas ou básicas.
É, então, necessário encontrar uma grandeza que nos permita estabelecer a diferença entre soluções mais ou menos ácidas, mais ou menos básicas ou soluções neutras.
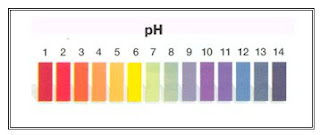
Para caracterizar quantitativamente a acidez ou basicidade das soluções, os químicos estabeleceram uma escala numérica, a escala de pH (fig.2). O pH de uma solução aquosa a 25ºC pode variar de 0 a 14, correspondendo o valor 7 às soluções neutras.
Uma solução é tanto mais ácida quanto menor for o seu valor de pH. Para soluções ácidas o pH é inferior a 7, ao passo que para soluções básicas ou alcalinas o pH é maior que 7. Uma solução é tanto mais alcalinas quanto maior for o seu pH.
Certas experiências têm a propriedade de, em contacto com soluções ácidas, básicas ou neutras, mudarem de cor, os indicadores ácido.base.
Os indicadores de ácido-base são ácidos ou bases orgânicos fracos em que os pares conjugados apresentam cores diferentes. A cor que apresentam em solução aquosa depende da abundância relativa das partículas (o ácido e a base conjugados) presentes, abundância esta que, por sua vez, depende do pH do meio.
Representando, genericamente, por Hind a forma ácida do indicador e por Ind- a sua base conjugada, a protólise do indicador será representada pela seguinte equação química:
Hind (aq) Ind- (aq) + H+
Os indicadores ácido-base, são geralmente pigmentos extraídos de plantas que servem para indicar o comportamento ácido, básico ou neutro de uma solução aquosa e os que nós usamos nesta experiência são a fenolftaleína (corante orgânico, sólido e branco, solúvel em álcool etílico), vermelho de bromofenol e o tornassol (corante azul extraído de líquenes).
Os químicos recorrem a estas substâncias para identificar o caracter químico das soluções. Na Tabela 1 apresentam-se as zona de viragem e cores para alguns indicadores. Na figura 3 mostram-se cores de alguns indicadores em várias soluções com diferentes valores de pH .
Nome do Indicador Zona de viragem Mudança de cor(ácido ® base)
Azul de timol 1.2 – 2.8 Vermelho - Amarelo
Alaranjado de metil 3.1 – 4.5 Vermelho - Amarelo
Vermelho de metilo 4.2 – 6.3 Vermelho - Amarelo
Tornassol 5.0 – 8.0 Vermelho - Azul
Vermelho de bromofeno 5.2 – 7.0 Amarelo - vermelho
Azul de bromotimo 6.0 – 7.6 Amarelo - Azul
Fenolftaleína 8.3 – 10.0 Incolor - vermelho
Amarelo de alizarina 10.0 – 12.1 Amarelo - vermelho
Para medir o pH de uma solução, podemos usar um indicador universal que é uma mistura de vários indicadores. É apresentado comercialmente sob a forma de papel indicador universal ou solução de indicador universal, com uma escala de cores de referência e produz uma gama de cores variáveis consoante o pH do meio. A figura 4 mostra as cores que o indicador universal apresenta em função do pH.
ABORTO,assista,pense,comente..
Ontem foi meu aniversário... Eu iria completar um mês de vida.
Pensei que você, Mamãe, fosse me dar uma festinha, como todas as mães.
Pensei que você, Mamãe, fosse dar ao Papai o beijo que gostaria de dar em mim... Porém, a festinha não foi alegre como eu esperava...
De fato, você foi à farmácia e comprou o meu presente. Pena que este presente tenha causado a minha morte e você não chorou nem um pouquinho. Por que?
Porque logo no dia do meu aniversário, pensei que você fosse ficar feliz com a minha chegada, mas você mamãe, não me deixou caminhar nem a metade: você barrou o meu caminho.
Eu sabia, sim, que durante uns meses eu iria estragar a sua elegância, eu seria um peso para a senhora, porém, eu havia prometido a mim mesmo que ficaria bem apertadinho para não prejudicar.
Eu deixaria para crescer depois que nascesse para o mundo.
Por que me tiraste a vida?
Eu sabia que em seu ventre a escuridão seria grande. Todavia, a luz que veria depois seria o bastante.
Eu iria conhecer o brilho do sol e das estrelas e, principalmente, conhecer Você e Papai.
E também teria que ficar muda durante nove meses, entretanto, iria lhe contar toda a minha felicidade de ter você como mãe.
Eu iria conversar muito com você quando estivesse triste, faria tudo para brotar em seus lábios um sorriso e quando estivesse alegre, faria tudo para que essa alegria durasse.
Sabe, eu planejei tanta coisa, mamãe... Queria crescer bastante e, depois de jovem, lutar com todas as minhas forças para que a guerra e o ódio acabassem e reinassem a paz no mundo.
Sim, eu queria tanta coisa, mas você não sentiu isto... VOCÊ ME ASSASSINOU!
Queria crescer, plantar no chão de minha existência, muitas rosas que o perfume inebriassem os homens e os deixassem incapazes de fabricarem máquinas que matam outros homens.
Engraçado... Eu pensei que os pais amassem seus filhos a ponto de lhes dar a própria vida. Você não me deixou viver nem a vida que eu mal começara.
Olhe, este era o meu plano quando estava em seu ventre, mamãe. Hoje não posso planejar nada, pois faço parte do mundo daqueles que nunca sentirão o perfume das rosas e nem chorarão a dor da morte.
Espero que você ao menos tenha se arrependido para que isto não aconteça com meus irmãozinhos que estão para vir.
Tchau... Mamãe... Eu lhe perdôo, apesar de tudo...
acidos e bases
Àcido-base e ph
No nosso quotidiano, muitas vezes nos questionamos onde podemos encontrar ácidos e bases (fig.1). Um dos conceitos que mais tem evoluído com o desenvolvimento da Química é o de ácido-base.
Para os egípcios, gregos e romanos o vinagre era a única substância ácida conhecida. Ele resultava da “azedia” ou oxidação do vinho pelo ar. Ácido significava, literalmente, azedo.
Entre os alcalis (da palavra árabe al kali, que significava cinzas de plantas), nome que se dá ás bases que se dissolvem em água, figuravam a “potassa” (carbonato de potássio), obtida de cinzas de madeira, a “soda” (carbonato de sódio), obtida da evaporação de águas minerais, e a “cal” (óxido de cálcio), obtida pelo aquecimento de conchas.
As bases são as substâncias capazes de produzir as soluções básicas ou alcalinas, sendo frequentemente escorregadias; o bicarbonato de sódio e o sabão são bases, assim como a soda cáustica, uma substância que pode queimar a pele.
Segundo Lewis, uma base é qualquer substância doadora de um par de electrões.
As bases mais importantes no laboratório são : hidróxido de sódio : NaHO, hidróxido de cálcio : Ca(HO)2 , hidróxido de magnésio : Mg(HO)2, hidróxido de amónio : NH4HO.
Na natureza os ácidos encontram-se nos frutos: o ácido cítrico é responsável pelo sabor amargo dos limões; o vinagre contém ácido acético; o ácido tânico da casca das árvores é usado no curtimento de peles. Os ácidos minerais mais fortes têm sido preparados desde a Idade Média. Um destes ácidos, aqua fortis (ácido nítrico), era usado pelos analistas para separar o ouro da prata. As baterias dos automóveis contêm ácido sulfúrico, um ácido forte e corrosivo. Uma base apresenta características opostas às de um ácido.
Os ácidos são as substâncias capazes de produzir as soluções ácidas. Os ácidos mais importantes no laboratório são : ácido clorídrico: HCl, ácido sulfuríco : H2SO4, , ácido nítrico : HNO3, ácido fosfórico : H3PO4, ácido acético : CH3COOH.
Segundo Lewis, um ácido é qualquer substância aceitadora de um par de electrões.
Há ainda substâncias que dissolvidas em água não tem comportamento ácido nem básico. São as soluções neutras. São exemplos, o cloreto de sódio e o sulfato de sódio em soluções aquosas
No entanto, as soluções ácidas não são todas iguais, assim como as soluções alcalinas ou básicas.
É, então, necessário encontrar uma grandeza que nos permita estabelecer a diferença entre soluções mais ou menos ácidas, mais ou menos básicas ou soluções neutras.
Para caracterizar quantitativamente a acidez ou basicidade das soluções, os químicos estabeleceram uma escala numérica, a escala de pH (fig.2). O pH de uma solução aquosa a 25ºC pode variar de 0 a 14, correspondendo o valor 7 às soluções neutras.
Uma solução é tanto mais ácida quanto menor for o seu valor de pH. Para soluções ácidas o pH é inferior a 7, ao passo que para soluções básicas ou alcalinas o pH é maior que 7. Uma solução é tanto mais alcalinas quanto maior for o seu pH.
Certas experiências têm a propriedade de, em contacto com soluções ácidas, básicas ou neutras, mudarem de cor, os indicadores ácido.base.
Os indicadores de ácido-base são ácidos ou bases orgânicos fracos em que os pares conjugados apresentam cores diferentes. A cor que apresentam em solução aquosa depende da abundância relativa das partículas (o ácido e a base conjugados) presentes, abundância esta que, por sua vez, depende do pH do meio.
Representando, genericamente, por Hind a forma ácida do indicador e por Ind- a sua base conjugada, a protólise do indicador será representada pela seguinte equação química:
Hind (aq) Ind- (aq) + H+
Os indicadores ácido-base, são geralmente pigmentos extraídos de plantas que servem para indicar o comportamento ácido, básico ou neutro de uma solução aquosa e os que nós usamos nesta experiência são a fenolftaleína (corante orgânico, sólido e branco, solúvel em álcool etílico), vermelho de bromofenol e o tornassol (corante azul extraído de líquenes).
Os químicos recorrem a estas substâncias para identificar o caracter químico das soluções. Na Tabela 1 apresentam-se as zona de viragem e cores para alguns indicadores. Na figura 3 mostram-se cores de alguns indicadores em várias soluções com diferentes valores de pH .
Nome do Indicador Zona de viragem Mudança de cor(ácido ® base)
Azul de timol 1.2 – 2.8 Vermelho - Amarelo
Alaranjado de metil 3.1 – 4.5 Vermelho - Amarelo
Vermelho de metilo 4.2 – 6.3 Vermelho - Amarelo
Tornassol 5.0 – 8.0 Vermelho - Azul
Vermelho de bromofeno 5.2 – 7.0 Amarelo - vermelho
Azul de bromotimo 6.0 – 7.6 Amarelo - Azul
Fenolftaleína 8.3 – 10.0 Incolor - vermelho
Amarelo de alizarina 10.0 – 12.1 Amarelo - vermelho
Também se pode medir o pH de uma solução utilizando um aparelho medidor de pH. Este aparelho permite a leitura directa do valor de pH da solução.
A escolha de um indicador ácido-base para uma titulação deve fazer-se de modo que o salto brusco do valor de pH (que deve existir na vizinhança do ponto de equivalência) tenha a zona de viragem contida nesse salto de pH e que a mesma englobe o pH desse ponto de equivalência. Só assim se pode detectar visualmente uma mudança súbita na cor da solução.
No nosso quotidiano, muitas vezes nos questionamos onde podemos encontrar ácidos e bases (fig.1). Um dos conceitos que mais tem evoluído com o desenvolvimento da Química é o de ácido-base.
Para os egípcios, gregos e romanos o vinagre era a única substância ácida conhecida. Ele resultava da “azedia” ou oxidação do vinho pelo ar. Ácido significava, literalmente, azedo.
Entre os alcalis (da palavra árabe al kali, que significava cinzas de plantas), nome que se dá ás bases que se dissolvem em água, figuravam a “potassa” (carbonato de potássio), obtida de cinzas de madeira, a “soda” (carbonato de sódio), obtida da evaporação de águas minerais, e a “cal” (óxido de cálcio), obtida pelo aquecimento de conchas.
As bases são as substâncias capazes de produzir as soluções básicas ou alcalinas, sendo frequentemente escorregadias; o bicarbonato de sódio e o sabão são bases, assim como a soda cáustica, uma substância que pode queimar a pele.
Segundo Lewis, uma base é qualquer substância doadora de um par de electrões.
As bases mais importantes no laboratório são : hidróxido de sódio : NaHO, hidróxido de cálcio : Ca(HO)2 , hidróxido de magnésio : Mg(HO)2, hidróxido de amónio : NH4HO.
Na natureza os ácidos encontram-se nos frutos: o ácido cítrico é responsável pelo sabor amargo dos limões; o vinagre contém ácido acético; o ácido tânico da casca das árvores é usado no curtimento de peles. Os ácidos minerais mais fortes têm sido preparados desde a Idade Média. Um destes ácidos, aqua fortis (ácido nítrico), era usado pelos analistas para separar o ouro da prata. As baterias dos automóveis contêm ácido sulfúrico, um ácido forte e corrosivo. Uma base apresenta características opostas às de um ácido.
Os ácidos são as substâncias capazes de produzir as soluções ácidas. Os ácidos mais importantes no laboratório são : ácido clorídrico: HCl, ácido sulfuríco : H2SO4, , ácido nítrico : HNO3, ácido fosfórico : H3PO4, ácido acético : CH3COOH.
Segundo Lewis, um ácido é qualquer substância aceitadora de um par de electrões.
Há ainda substâncias que dissolvidas em água não tem comportamento ácido nem básico. São as soluções neutras. São exemplos, o cloreto de sódio e o sulfato de sódio em soluções aquosas
No entanto, as soluções ácidas não são todas iguais, assim como as soluções alcalinas ou básicas.
É, então, necessário encontrar uma grandeza que nos permita estabelecer a diferença entre soluções mais ou menos ácidas, mais ou menos básicas ou soluções neutras.
Para caracterizar quantitativamente a acidez ou basicidade das soluções, os químicos estabeleceram uma escala numérica, a escala de pH (fig.2). O pH de uma solução aquosa a 25ºC pode variar de 0 a 14, correspondendo o valor 7 às soluções neutras.
Uma solução é tanto mais ácida quanto menor for o seu valor de pH. Para soluções ácidas o pH é inferior a 7, ao passo que para soluções básicas ou alcalinas o pH é maior que 7. Uma solução é tanto mais alcalinas quanto maior for o seu pH.
Certas experiências têm a propriedade de, em contacto com soluções ácidas, básicas ou neutras, mudarem de cor, os indicadores ácido.base.
Os indicadores de ácido-base são ácidos ou bases orgânicos fracos em que os pares conjugados apresentam cores diferentes. A cor que apresentam em solução aquosa depende da abundância relativa das partículas (o ácido e a base conjugados) presentes, abundância esta que, por sua vez, depende do pH do meio.
Representando, genericamente, por Hind a forma ácida do indicador e por Ind- a sua base conjugada, a protólise do indicador será representada pela seguinte equação química:
Hind (aq) Ind- (aq) + H+
Os indicadores ácido-base, são geralmente pigmentos extraídos de plantas que servem para indicar o comportamento ácido, básico ou neutro de uma solução aquosa e os que nós usamos nesta experiência são a fenolftaleína (corante orgânico, sólido e branco, solúvel em álcool etílico), vermelho de bromofenol e o tornassol (corante azul extraído de líquenes).
Os químicos recorrem a estas substâncias para identificar o caracter químico das soluções. Na Tabela 1 apresentam-se as zona de viragem e cores para alguns indicadores. Na figura 3 mostram-se cores de alguns indicadores em várias soluções com diferentes valores de pH .
Nome do Indicador Zona de viragem Mudança de cor(ácido ® base)
Azul de timol 1.2 – 2.8 Vermelho - Amarelo
Alaranjado de metil 3.1 – 4.5 Vermelho - Amarelo
Vermelho de metilo 4.2 – 6.3 Vermelho - Amarelo
Tornassol 5.0 – 8.0 Vermelho - Azul
Vermelho de bromofeno 5.2 – 7.0 Amarelo - vermelho
Azul de bromotimo 6.0 – 7.6 Amarelo - Azul
Fenolftaleína 8.3 – 10.0 Incolor - vermelho
Amarelo de alizarina 10.0 – 12.1 Amarelo - vermelho
Também se pode medir o pH de uma solução utilizando um aparelho medidor de pH. Este aparelho permite a leitura directa do valor de pH da solução.
A escolha de um indicador ácido-base para uma titulação deve fazer-se de modo que o salto brusco do valor de pH (que deve existir na vizinhança do ponto de equivalência) tenha a zona de viragem contida nesse salto de pH e que a mesma englobe o pH desse ponto de equivalência. Só assim se pode detectar visualmente uma mudança súbita na cor da solução.
`´Acidos e Bases `´
Importante: estas notas destinam-se
exclusivamente a servir como guia de
estudo. Figuras e tabelas de outras
fontes foram reproduzidas
estritamente com finalidade didática.
Preparado em
Linux com
L
ATEX2". aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 1 / 63
Ácidos e bases
Definição de Brønsted-Lowry (1923)
definição mais abrangente que a de Arrhenius
“ácidos” e “bases”
=) ácidos e bases de Brønsted ácido:
doador de próton base:
receptor de próton aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 2 / 63
Ácidos e bases
Definições
deprotonação:
perda de um próton protonação:
ganho de um próton ácido :
Ex.:
doa apenas 1 próton H
H
(aquele pode pode ser liberado como próton)
Cl, CH3COOH átomo de hidrogênio acídico ácido poliprótico:
Ex.:
pode doar mais que 1 próton H
2SO4 (HSO− 4
=) mais difícil de doar) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 3 / 63
Par ácido-base conjugado
Compostos ou íons que diferem pela presença de um próton
a base conjugada de um ácido de Brønsted é a espécie que resulta
quando um próton é removido do ácido
vice-versa, o ácido conjugado resulta quando um próton é adicionado à
base
dizemos “um ácido e sua base conjugada” ou “uma base e seu ácido
conjugado”
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 4 / 63
Ácidos e bases
O íon hidrônio
há evidências de que uma espécie encontrada em solução seja o íon
hidrônio hidratado:
ligação de hidrogênio a 3 moléculas
H9O4, constituido de um íon central H3O+ ligado porH2O aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 5 / 63
Ácidos e bases
Ácido: doador de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 6 / 63
Ácidos e bases
Ácido: doador de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 7 / 63
Ácidos e bases
Ácido: doador de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 8 / 63
Ácidos e bases
Ácido: doador de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 9 / 63
Ácidos e bases
Ácido: doador de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 10 / 63
Ácidos e bases
Base: receptor de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 11 / 63
Ácidos e bases
Base: receptor de próton
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 12 / 63
Ácidos e bases
Água: caráter
anfiprótico algumas substâncias exibem caráter anfiprótico: podem agir tanto como
doadores quanto como receptores de prótons
Ex.: água
H
2O agindo como base ao aceitar um próton para formar H3O+ HCl
(aq) + H2O(l) H3O+(aq) + Cl−(aq) H
2O agindo como ácido ao ceder um próton e formar OH− NH
3(aq) + H2O(l) NH+ 4
(aq) + OH−(aq) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 13 / 63
Autoprotólise (ou “autoionização”) da água
2
H2O(l) H3O+(aq) + OH−(aq) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 14 / 63
Autoprotólise (ou “autoionização”) da água
K
w - constante de autoprotólise podemos calcular a constante de equilíbrio para a reação de
autoprotólise da água
2
H2O(l) H3O+(aq) + OH−(aq) utilizando a relação
rG = −RT lnK para a reação como escrita, utilizamos dados tabelados para obter
= +
rG = rG [H3O+(aq)] + rG [OH−(aq)] − 2 × rG [H2O(l)]79, 89 kJ · mol−1 =
) K = exp −
rG RT
=
1, 0 × 10−14 aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 15 / 63
Autoprotólise (ou “autoionização”) da água
K
w = 1, 0 × 10−14 2
H2O(l) H3O+(aq) + OH−(aq) apenas uma pequena
fração das moléculas de
água estão presentes na
forma de íons
dificuldade em romper
ligação
que apenas uma pequena
fração de prótons é
transferida
O − H, de modo aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 16 / 63
Autoprotólise (ou “autoionização”) da água
K
w - constante de autoprotólise para o equilíbrio
2
H2O(l) H3O+(aq) + OH−(aq) K = 1, 0 × 10−14 temos
K
= a
H3O+aOH− (
aH2O)2 no caso de soluções aquosas muito diluídas, o solvente (água) está
praticamente puro, de modo que sua atividade pode ser aproximada para
a
substituindo este valor na expressão anterior, obtemos a
H2O = 1 constante de autoprotólise da água:
K
w = aH3O+aOH− aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 17 / 63
Autoprotólise (ou “autoionização”) da água
K
w - constante de autoprotólise temos que
K
w = aH3O+aOH− como os íons
atividades podem ser aproximadas por molaridades, levando a
H3O+ e OH− são solutos, se a solução for bem diluída, K
w = [H3O+][OH−] a 25
experimentalmente e são iguais a 1
C, estas concentrações molares podem ser determinadas, 0 × 10−7 substituindo estes valores, obtemos o valor esperado, concordando com
os cálculos termodinâmicos:
K
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 18 / 63
w = [H3O+][OH−] = (1, 0 × 10−7)(1, 0 × 10−7) = 1, 0 × 10−14 Autoprotólise (ou “autoionização”) da água
K
w = [H3O+][OH−] - constante de autoprotólise numa solução aquosa, podemos interferir
nas concentrações dos íons
H3O+ e OH− adicionando ácidos ou bases
a relação
Kw = [H3O+][OH−] é sempre válida
pura ou uma solução com espécies
dissolvidas:
, quer tenhamos água "
[H3O+] =)# [OH−] #
[H3O+] =)" [OH−] aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 19 / 63
Escala de pH
as concentrações molares
de grandeza
em casos como este, um meio de otimizar os cálculos é trabalhar com
funções logarítmicas, que variam mais lentamente
ao invés de utilizar
uma definição mais geral é dada a partir da atividade
[H3O+] e [OH−] podem variar muitas ordens[H3O+], utilizamos seu logaritmo em base 10aH3O+: pH
= −log aH3O+ note que o pH é um número adimensional
o sinal negativo na definição é adotado para levar, na grande maioria dos
casos, a números positivos, mais fáceis para uso no dia-a-dia
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 20 / 63
Escala de pH
em soluções diluídas, que podem ser tratados como ideais, a atividade
reduz-se à concentração molar do soluto, de modo que
pH
= −log[H3O+] pH:
aproximado seria a “potência de concentração do hidrogênio”
note que utilizamos
termo deriva do latim pondus hydrogenii, cujo significado[H3O+] sem unidades na expressão acima aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 21 / 63
Escala de pH
pH
= −log[H3O+] K
w = [H3O+][OH−] = 1, 0 × 10−14 (25 C) #
[H3O+] =)" [OH−] "
[H3O+] =)# [OH−] aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 22 / 63
Outras escalas logarítmicas
podemos definir, de forma análoga ao pH, escalas logarítmicas para
outras grandezas
pX
= −logX em particular, temos
pOH
= −log aOH− que, na maioria dos casos, pode ser escrito como
pOH
= −log[OH−] de modo similar,
pK
w = −logKw = −log(1, 0 × 10−14) = −(−14) = 14 aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 23 / 63
pH
+ pOH = pKw note que
[
H3O+][OH−] = Kw =) log[H3O+] + log[OH−] = logKw disto, obtemos
−
log[H3O+] − log[OH−] = −logKw =) pH + pOH = pKw =
) pH + pOH = 14 aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 24 / 63
Escala de pH
pH
+ pOH = 14 aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 25 / 63
Ácidos e bases
Definições
ácido forte:
Idealmente, todas as moléculas (ou íons) doam seu próton.
Ex.:
completamente deprotonado em solução. HCl
(g) + H2O(l) H3O+(aq) + Cl−(aq) ácido fraco:
deprotona em solução.
Ex.:
apenas uma pequena fração das moléculas (ou íons) se CH
3COOH(aq) + H2O(l) H3O+(aq) + CH3COO−(aq) CH
3COOH 0.1 mol · L−1 =) (CH3COO− : CH3COOH) ' (1 : 100) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 26 / 63
Ácidos e bases
Definições
CH
3COOH(aq) + H2O(l) H3O+(aq) + CH3COO−(aq) CH
3COOH 0.1 mol · L−1 =) (CH3COO− : CH3COOH) ' (1 : 100) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 27 / 63
Ácidos e bases
Filme ilustrando ácidos fortes e ácidos fracos
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 28 / 63
Ácidos e bases
Definições
base forte:
Idealmente, todas as moléculas (ou íons) adquirem um próton.
Ex.:
completamente protonada em solução. NaOH
(s) H
2O /
Na+(aq) + OH−(aq) base fraca:
protona em solução.
Ex.:
apenas uma pequena fração das moléculas (ou íons) se NH
3(aq) + H2O(l) NH+ 4
(aq) + OH−(aq) apenas uma pequena fração das moléculas de amônia se protona
gerando íons amônio
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 29 / 63
Ácidos e bases
Ácidos e bases fortes
em água, a maioria dos ácidos são fracos
em água, a maioria das bases são fracas
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 30 / 63
Ácidos e bases
Filme ilustrando bases fortes e bases fracas
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 31 / 63
Ácidos e bases
Importante
se um ácido é forte, sua base conjugada necessariamente é fraca
H
3O+ é o ácido mais forte que pode existir em solução aquosa: =
próprio
Ex.:
) acidos mais fortes que este reagem com água para produzir oH3O+ e as respectivas bases conjugadas. HCl
(aq) + H2O(l) H3O+(aq) + Cl−(aq) ácidos mais fracos que
produzindo
Ex.:
H3O+ reagem com a água em menor extensão,H3O+ e respectivas bases conjugadas. HF
(aq) + H2O(l) H3O+(aq) + F−(aq) (equilíbrio favorece forma molecular do ácido
HF) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 32 / 63
Ácidos e bases
Importante
se uma base é forte, seu ácido conjugado necessariamente é fraco
HO
− é a base mais forte que pode existir em solução aquosa: =
próprio
Ex.:
) bases mais fortes que esta reagem com água para produzir oHO− e as respectivas bases conjugadas. O
−2(aq) + H2O(l) 2OH−(aq) (por isto o íon
em solução aquosa pode-se representar o íon ácido tanto por
por
O−2 não existe em soluções aquosas)H+ quantoH3O+ aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 33 / 63
A força relativa de ácidos e bases conjugados
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 34 / 63
A força relativa de ácidos e bases conjugados
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 35 / 63
Constantes de acidez e basicidade
K
a - constante de acidez (ou constante de dissociação ácida) a ionização de um ácido monoprótico em água (reação de transferência
de prótons do ácido para a água) pode ser representada genericamente
por
HA
(aq) + H2O(l) H3O+(aq) + A−(aq) a constante de equilíbrio para esta reação será
K
= a
H3O+aA− a
HAaH2O a grande maioria dos ácidos são fracos em solução aquosa, a solução é
muito diluída e a água permanece praticamente pura, de modo que
podemos fazer
concentrações molares, levando à
aH2O = 1 e aproximar as outras atividades porconstante de acidez Ka aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 36 / 63
Constantes de acidez e basicidade
K
a - constante de acidez (ou constante de dissociação ácida) HA
(aq) + H2O(l) H3O+(aq) + A−(aq) constante de acidez:
K
[
[
a =H3O+][A−]HA] numa dada temperatura, a força de um ácido
magnitude de sua constante de dissociação
maior
no equilíbrio, a dissociação do ácido resulta numa maior a concentração
de íons
HA é medida pelaKa =) ácido mais forte:H3O+ aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 37 / 63
Constantes de acidez e basicidade
Percentagem de ionização
considerando novamente
HA
(aq) + H2O(l) H3O+(aq) + A−(aq) temos que, no equilíbrio,
[H3O+] = [A−] 1
mol A− l 1 mol H3O+ =) [H3O+] = [A−] de onde definimos a
(ou deprotonação do ácido)
percentagem de ionização percentagem de ionização
[
[
=A−]HA]inicial ×
[
[
100% =H3O+]HA]inicial ×
100% aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 38 / 63
Constantes de acidez e basicidade
Percentagem de ionização
quanto mais diluída a solução, maior a percentagem de ionização
maior diluição
=
de acordo com o Princípio de Le
Chatelier, sistema reage de modo a
minimizar a perturbação, produzindo
mais partículas, ou seja, dissociando
mais ácido
termodinamicamente, temos
) menor número de partículas K
a = n
H3O+nA− n
HA ×
1
V
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 39 / 63
Constantes de acidez e basicidade
K
(ou constante de dissociação básica)
b - constante de basicidade a ionização de bases fracas em solução aquosa (reação de transferência
de prótons da água para a base) é tratada da mesma forma que a
ionização de ácidos fracos
considere a reação abaixo
NH
3(aq) + H2O(l) NH+ 4
(aq) + OH−(aq) a constante de equilíbrio para será
K
= a
NH+ 4
a
OH− a
NH3aH2O aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 40 / 63
Constantes de acidez e basicidade
K
(ou constante de ionização básica)
b - constante de basicidade com as mesmas aproximações de antes, definimos a
basicidade:
constante de K
[
b =NH+ 4
[
][OH−]NH3] numa dada temperatura, a força de uma base é medida pela magnitude
de sua constante de basicidade
maior
no equilíbrio, a ionização da base resulta numa maior a concentração de
íons
Kb =) base mais forte:OH− aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 41 / 63
Constantes de acidez e basicidade
Relação entre
Ka e Kb existe uma relação importante entre
conjugada, onde exemplificamos com ácido acético:
Ka e um ácido e Kb de sua base CH
3COOH(aq) + H2O(l) H3O+(aq) + CH3COO−(aq) Ka CH
3COO−(aq) + H2O(l) CH3COOH(aq) + OH− Kb somando as duas equações, a constante de equilíbrio resultante será o
produto das suas constantes
uma vez que a equação final representa nada mais que a autoprotólise
da água de modo que obtemos exatamente
Kw: CH
3COOH(aq) + H2O(l) H3O+(aq) + CH3COO−(aq) Ka CH
3COO−(aq) + H2O(l) CH3COOH(aq) + OH− Kb 2
H2O(l) H3O+ + OH− Kw = KaKb aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 42 / 63
Constantes de acidez e basicidade
Relação entre
Ka e Kb em palavras, para qualquer par ácido-base conjugados, vale
K
w = KaKb isto confirma a observação de que quanto mais forte o ácido, mais fraca
a base conjugada (e vice-versa):
K
a = K
w K
b K
b = K
w K
a aplicando logaritmo em ambos os lados da primeira relação, também
podemos escrever que
log
Ka + logKb = logKw =) pKa + pKb = pKw aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 43 / 63
Constantes de acidez
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 44 / 63
Constantes de basicidade
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 45 / 63
Pares ácido-base conjugados
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 46 / 63
Ácidos polipróticos
ácidos polipróticos podem liberar mais de 1 próton
neste caso, temos duas constantes de equilíbrio. Ex.:
H
2CO3(aq) H+(aq) + HCO− 3
[
(aq) Ka1 =H+][HCO− 3
[
]H2CO3] HCO
− 3
(aq) H+(aq) + CO2− 3
[
(aq) Ka2 =H+][CO2− 3
[
]HCO− 3
] note que a base conjugada no primeiro estágio de ionização torna-se o
ácido no segundo estágio
quanto menos negativa a espécie, mais fácil remover um próton:
K
a1 Ka2 ou seja, praticamente, todo o aumento em
apenas ao primeiro estágio de ionização
[H+] é devido quase que aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 47 / 63
Ácidos polipróticos
ainda considerando
H
2CO3(aq) H+(aq) + HCO− 3
[
(aq) Ka1 =H+][HCO− 3
[
]H2CO3] HCO
− 3
(aq) H+(aq) + CO2− 3
[
(aq) Ka2 =H+][CO2− 3
[
]HCO− 3
] vemos que, quando o primeiro estágio atinge o equilíbrio,
1
mol HCO− 3
l 1 mol H+ =) [HCO− 3
] = [H+] isto implica que a concentração inicial da base no segundo estágio é
K
[
a2 =H+][CO2− 3
[
]HCO− 3
=
]) [CO2− 3
] = Ka2 aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 48 / 63
Ácidos polipróticos
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 49 / 63
Ácidos polipróticos
ácido sulfúrico
(
ácido fosfórico
(
H2SO4, diprótico)H3PO4, triprótico) aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 50 / 63
Estrutura molecular
× força de ácidos a força de um ácido (ou base) depende de vários fatores, entre eles:
propriedades do solvente
concentração
temperatura
estrutura molecular
para avaliar apenas o efeito da estrutura, vamos considerar o mesmo
solvente, temperatura e concentração
embora difícil de predizer o comportamento de um ácido através da
estrutura, dois fatores estruturais principais influenciam sua dissociação:
HA
! H+ + A− a intensidade da ligação
H − A a polaridade da ligação
H − A aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 51 / 63
Estrutura molecular
× força de ácidos Energia de dissociação da ligação
H − A menor energia da ligação
H − A =) mais forte o ácido HA Ex.:
em água, a força dos ácidos cresce no sentido
HF
HCl < HBr < HI aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 52 / 63
Estrutura molecular
× força de ácidos Energia de dissociação de ligações com
H aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 53 / 63
Estrutura molecular
× força de ácidos Polaridade da ligação
H − A maior
ligação mais polar
=) mais polar a ligação =
) maior acúmulo de carga positiva no hidrogênio =
) mais fácil ele se solta maior eletronegatividade de
A =) mais forte o ácido HA Ex.: solvente água, ligação
o próton se solta do ácido
H2O · · ·H − A se intensifica e mais facilmente aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 54 / 63
Estrutura molecular
× força de ácidos Oxiácidos
oxiácidos:
central
em quase todos os casos, o hidrogênio acídico está no grupo
polaridade é alta, permitindo a liberação mais fácil do próton
Ex.: ácido fosforoso (
ácidos contendo hidrogênio, oxigênio e algum outro elemento−OH, cujaH3PO3, triprótico) (P) < (O) =) H ligado ao P não é acídico aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 55 / 63
Estrutura molecular
× força de ácidos Oxiácidos
podemos comparar a força de oxiácidos dividindo-os em 2 grupos
oxiácidos cujos elementos centrais pertencem a um mesmo grupo da
tabela periódica e têm o mesmo número de oxidação
neste caso, a força do ácido cresce com a eletronegatividade do átomo
central
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 56 / 63
Estrutura molecular
× força de ácidos Oxiácidos
oxiácidos com o mesmo elemento central e números diferentes de
grupos ligados
a força do ácido cresce
com o número de
oxidação do átomo
central
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 57 / 63
Estrutura molecular
× força de ácidos Ácidos orgânicos
os principais ácidos orgânicos são os
grupo carboxil,
ácidos carboxílicos, que contém o−COOH ácido acético
ácido benzóico
ácido acetilsalicílico (aspirina)
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 58 / 63
Estrutura molecular
× força de ácidos Ácidos orgânicos
embora os ácidos carboxílicos sejam ácidos fracos, eles são muito mais
fortes que álcoois, por exemplo, que também possuem um um grupo
−
OH aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 59 / 63
Estrutura molecular
× força de ácidos Ácidos orgânicos
K
a(etanol) Ka(ácido acético) um fator que explica esta diferença é o segundo oxigênio do ácido, que
atrai a nuvem eletrônica deixando o
positiva
H do grupo carboxil com maior carga aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 60 / 63
Estrutura molecular
× força de ácidos Ácidos orgânicos
K
a(etanol) Ka(ácido acético) um segundo fator realcionado a esta diferença é a base conjugada do
ácido
o segundo oxigênio do grupo carboxil é mais um átomo eletronegativo, o
que faz com que a carga fique mais deslocalizada, sendo menos efetiva
na atração de prótons e, portanto, tornando a base mais fraca
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 61 / 63
Estrutura molecular
× força de ácidos Ácidos orgânicos
a figura compara a base do ácido acético (estruturas de ressonância do
íon acetato) com a base do etanol (íon etóxido)
note a deslocalização de carga no grupo carboxil
aparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 62 / 63
Estrutura molecular
× força de ácidosaparicio@iqm.unicamp.br () QG107 - 1s/2009 Aula 8 - Ác./Bases/pH 63 / 63 Aula 8
Ácidos e Bases / pH
Prof. Ricardo Aparicio - IQ/Unicamp - 1s/2009
QG107 (Biologia) - 1s/2009
Assinar:
Comentários (Atom)